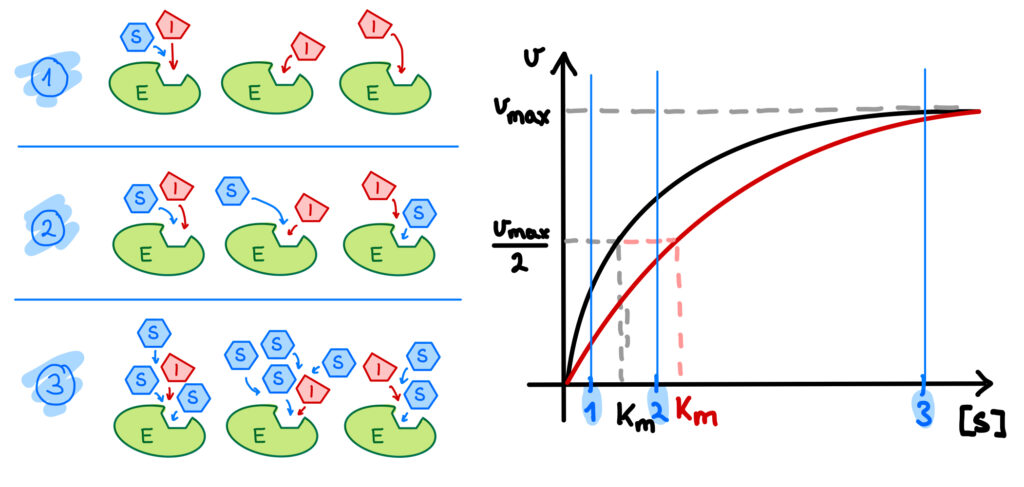
Einige Inhibitoren können wie das Substrat an das aktive Zentrum eines Enzyms binden. Diese Form der Enzymhemmung nennt man kompetitive Hemmung: Der Inhibitor steht nämlich in einem Wettkampf mit dem Substrat um den Platz im aktiven Zentrum („Wettkampf“ auf Englisch heißt „competition“).
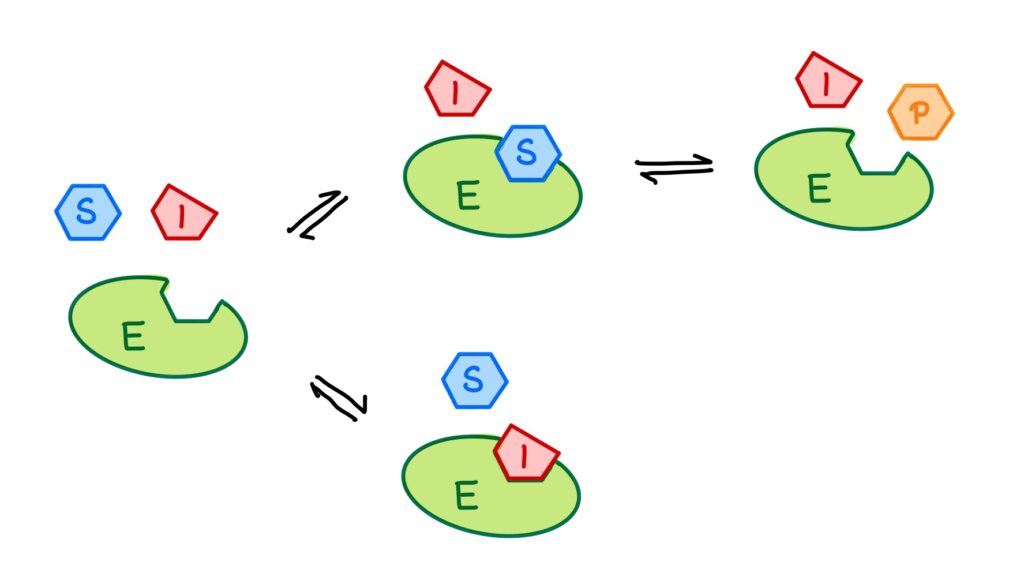
Besetzt also ein Inhibitor das aktive Zentrum eines Enzyms, so ist dort kein Platz für ein Substratmolekül und die Substratumsetzung wird gehemmt. Die kompetitive Hemmung ist ein reversibler also umkehrbarer Inhibierungstyp, denn der Inhibitor löst sich nach einiger Zeit vom Enzym und das aktive Zentrum ist wieder frei für ein weiteres Substrat- oder Inhibitormolekül.
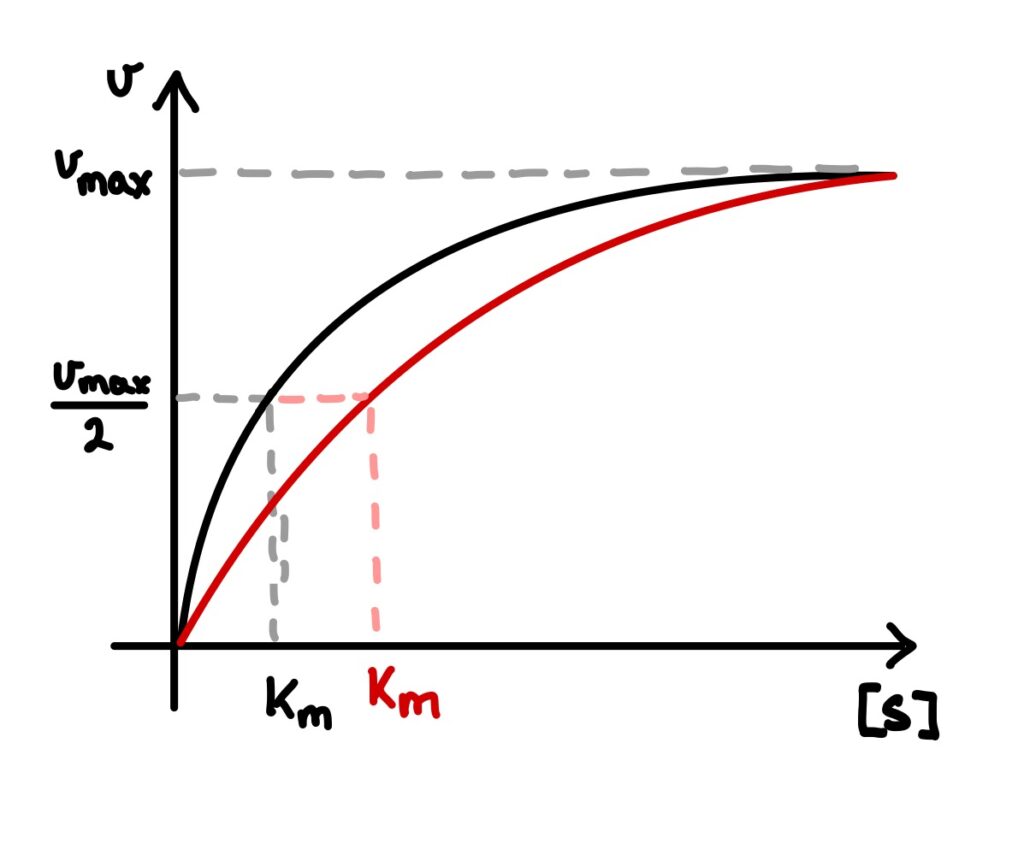
Welchen Einfluss hat die kompetitive Hemmung auf die Kinetik des Enzyms? Schauen wir uns dafür das Michaelis-Menten-Diagramm für eine feste Inhibitorkonzentration und feste Reaktionsbedingungen an. Zur Erinnerung: Die Substratkonzentration [S] wird variiert und die resultierende Reaktionsgeschwindigkeit v im Diagramm aufgetragen. Die rote Kurve beschreibt den Verlauf mit Inhibitor, die schwarze den Verlauf ohne.
Es ist zu erkennen: Die Kurve mit Inhibitor verläuft weniger steil als die ohne, erreicht aber bei einer hohen Substratkonzentration die gleiche Maximalgeschwindigkeit vmax. Der Km-Wert, also die Substratkonzentration bei der die Hälfte der Maximalgeschwindigkeit vmax erreicht wird, ist allerdings höher.
Aber warum ist das so? Jetzt bist du an der Reihe:
Ziehe die Wörter in die richtigen Felder! Schaue dir dafür das Bild genauer an: