Wie du wahrscheinlich weißt, gibt es drei verschiedene Aggregatzustände: fest, flüssig und gasförmig. Zum Beispiel wird Wasser je nach Aggregatzustand als Eis, Wasser oder Wasserdampf bezeichnet.
Was in der Schule häufig nicht erwähnt wird, ist dass es auch einen überkritischen Zustand gibt. Aber wie können wir uns den überhaupt vorstellen?
| fest | flüssig | gasförmig | überkritisch |
 |  |  |  |
Quelle: https://de.serlo.org/chemie/25371/aggregatzustand, Lizenz CC-BY-SA 4.0
Dazu wollen wir erst einmal ein bisschen ausholen: Welchen Aggregatzustand ein Stoff hat, hängt von der Temperatur und vom Druck ab, daher können Stoffe bei Temperatur- oder Druckänderung ihren Aggregatzustand wechseln. Einfache Beispiele sind das Gefrieren von Wasser im Gefrierfach oder das Verdampfen im Kochtopf: Hierbei wird jeweils die Temperatur verändert, um den Wechsel des Aggregatzustandes herbeizuführen. Doch auch der Druck hat einen Einfluss: vielleicht weißt du, dass die Tatsache, dass Wasser bei 100 ° C siedet, nur bei Normaldruck gilt. In einem Schnellkochtopf kann man den Druck erhöhen, damit das Wasser erst bei höherer Temperatur z.B. 120 °C zu sieden beginnt. Durch die höherer Temperatur brauchen die Speisen nicht so lang, um weich zu werden, was Zeit und Energie spart. Wenn man stattdessen auf einem hohen Berg, wo der Luftdruck geringer ist, kochen will, siedet das Wasser schon bei niedrigeren Temperaturen, aber die Speisen brauchen länger zum Garen.
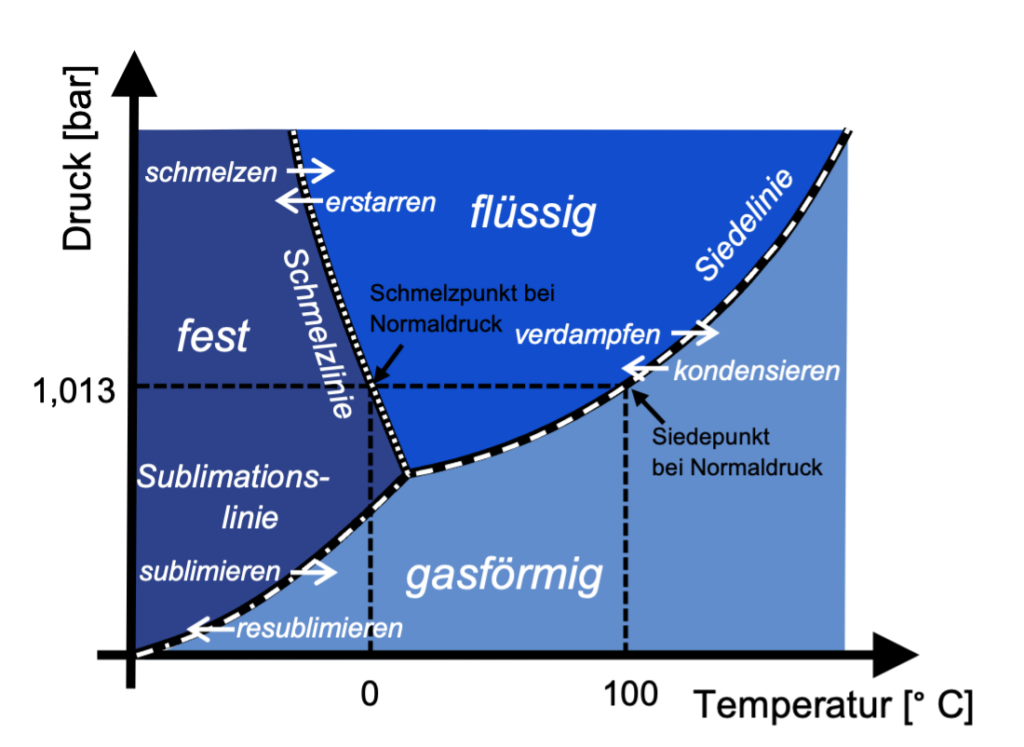
Da der Aggregatzustand von der Temperatur und dem Druck abhängt, ist auch der Übergang zwischen zwei Aggregatzuständen temperatur- und druckabhängig. Es gibt also nicht nur eine Siedetemperatur oder einen Siedepunkt, sondern eine Siedelinie, die die Siedetemperatur in Abhängigkeit vom Druck zeigt.
Das Phasendiagramm
In einem Phasendiagramm (siehe Abbildung 2) kann man die Aggregatzustände in Abhängigkeit von Druck und Temperatur darstellen mit Linien, die jeweils die Übergänge zwischen den Phasen darstellen.
Der Einfluss von Temperatur und Druck erklärt im Teilchenmodell
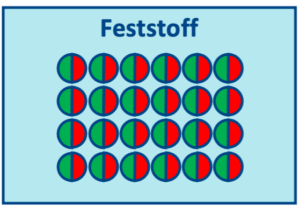
Die Aggregatzustände kann man sich im Teilchenmodell veranschaulichen: Im festen Zustand sind die Teilchen dicht beieinander und können sich kaum bewegen. Meist werden sie als einfarbige Kugeln dargestellt, aber da auch Anziehungskräfte zwischen den Teilchen eine Rolle spielen, sind sie hier wie Magnete in rot-grün dargestellt (unterschiedliche Farben ziehen sich an, gleiche stoßen sich ab). Wenn man einen Feststoff erhitzt, bewegen sich die Teilchen etwas mehr, daher dehnt sich der Feststoff aus. Gleichzeitig werden die Anziehungskräfte durch den größeren Abstand schwächer. (Ausnahme: Wasser zwischen 0 und 4 °C dehnt sich beim Abkühlen aus, siehe Dichteanomalie des Wassers)
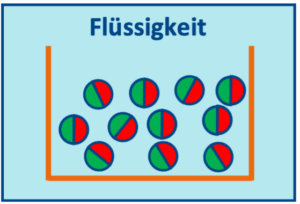
Wenn man beim Erhitzen den Schmelzpunkt erreicht, lösen sich immer mehr Teilchen aus der engen Feststoffanordnung und gehen in den flüssigen Zustand über. Dort sitzen sie nicht mehr an einer festen Stelle sondern können sich gegenseitig verschieben. Dadurch haben Flüssigkeiten keine feste Form, aber noch ein abgegrenztes Volumen. Wenn man die Flüssigkeit dann weiter erhitzt, gilt wie in der Feststoffphase: den Teilchen wird mehr Energie zugefügt, sodass sie sich mehr bewegen. Dabei wird der Abstand größer, und die Flüssigkeit dehnt sich aus.
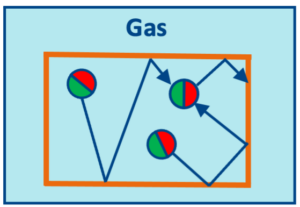
Durch weiteres Erhitzen wird auch hier irgendwann ein Schwellenwert erreicht: der Siedepunkt. An diesem Punkt lösen sich immer mehr Teilchen aus den Anziehungskräften, die noch in der Flüssigphase wirken, und bewegen sich als einzelne Teilchen frei im Raum. Damit sind sie im gasförmigen Zustand, wo sie am meisten Abstand haben und sich sehr schnell bewegen. (Ein zufälliger Zusammenstoß von solchen Teilchen führt aufgrund der hohen Geschwindigkeit eher zum Abprallen als dass hier wieder die Anziehungskräfte zum Tragen kämen.)
Bis hier wurde der Einfluss der Temperatur auf den Aggregatzustand beschrieben.
Welchen Einfluss hat aber der Druck? Wenn man den Druck erhöht, sperrt man dieselbe Menge Teilchen in ein kleineres Volumen. Sie kommen sich dann wieder näher. Besonders leicht geht das, wenn die Teilchen in der Gasphase sind. Sie lassen sich dann leicht zusammendrücken. In der Flüssig- und insbesondere der Feststoffphase müssen hohe Drücke aufgewendet werden, um die Teilchen noch dichter zusammenzupressen.
Wenn man sich veranschaulicht, dass sich die Teilchen in einer Flüssigkeit umso mehr bewegen, je heißer sie ist und gleichzeitig, dass ein Gas umso mehr Teilchen enthält, je höher der Druck ist, so kann man sich vielleicht vorstellen, dass bei gleichzeitigem Vorliegen von hohen Temperaturen und hohen Drücken der Unterschied zwischen Gas- und Flüssigphase verschwindet. An diesem Punkt ist der überkritische Zustand erreicht.
WICHTIG: Im überkritischen Zustand gibt es keinen Unterschied zwischen Gas- und Flüssigphase. Er wird bei hohen Temperaturen und Drücken erreicht. Wie hoch diese genau sind, ist stoffabhängig.
Kann man den überkritischen Zustand sehen?
Ja! Wie genau er aussieht und wie man ihn mit dem Phasendiagramm eines Stoffes beschreiben kann lernst du im folgenden Video:
Forscher können in Experimenten beobachten, wann der kritische Punkt erreicht ist: Dazu nutzen sie eine Sichtzelle, einen druckfesten beheizbaren Behälter mit Fenster und füllen dort z.B. Wasser ein und bringen es zum Sieden. Am Siedepunkt sehen sie eine flüssige und eine gasförmige Phase, die durch eine Phasengrenze getrennt werden.

Wenn man nun den Druck und die Temperatur gleichzeitig jeweils so erhöht, dass man auf der Siedelinie bleibt, dann kommt man irgendwann an den kritischen Punkt, ab dem der Unterschied zwischen Gas- und Flüssigphase verschwindet. Dort sieht man dann keine Phasengrenzfläche mehr. Das Verschwinden dieser Linie ist also das Einzige, was man sehen kann.
Im Phasendiagramm ist der kritische Punkt das obere Ende der Siedelinie. Darüber beginnt der überkritische Zustand. Vergleichen wir den überkritischen Zustand von Wasser und Kohlendioxid:
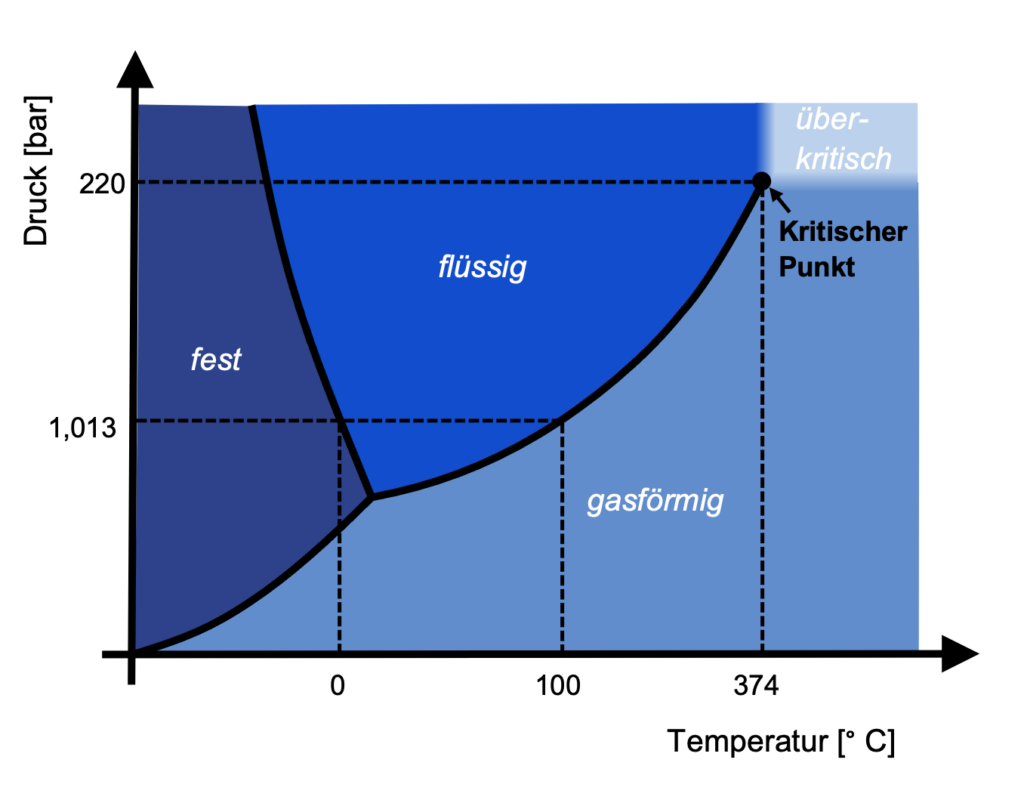
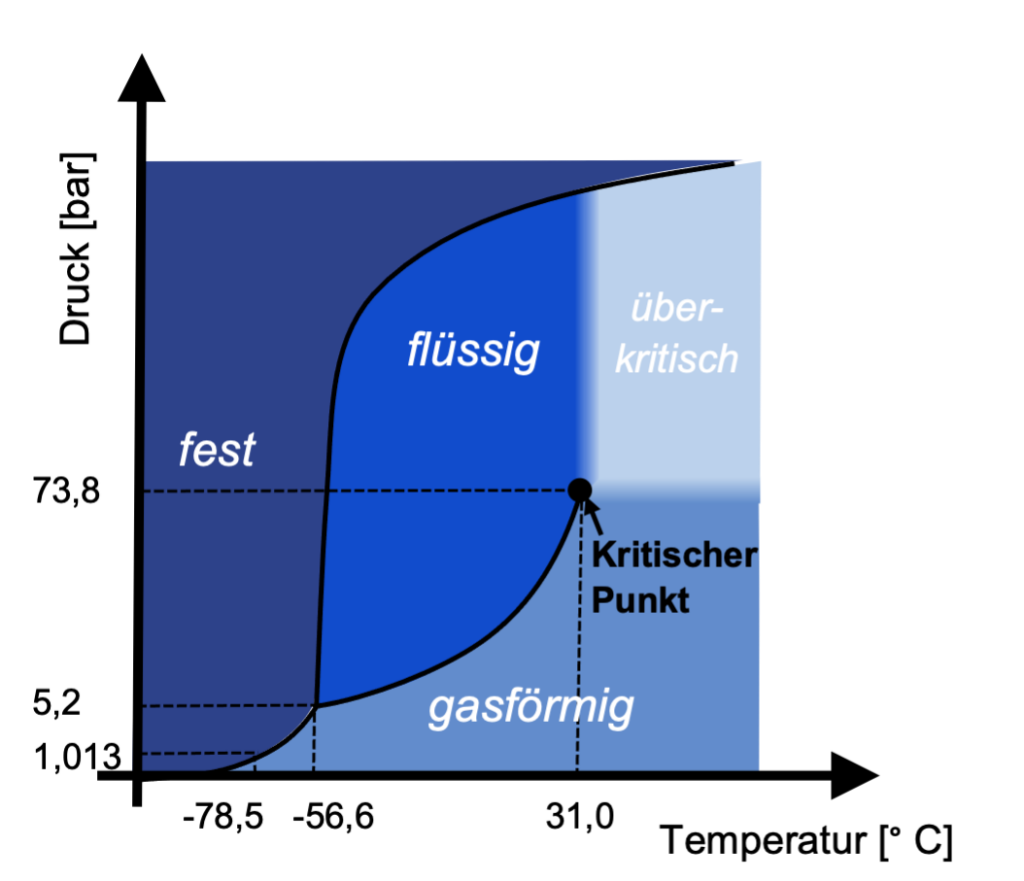
Um den überkritischen Zustand von Wasser zu erreichen, braucht man einen sehr hohen Druck von 220 bar und eine hohe Temperatur: 374 °C. Bei vielen anderen Stoffen sind die Werte geringer, z.B. benötigt man bei Kohlendioxid nur 73,8 bar und 31 °C.
